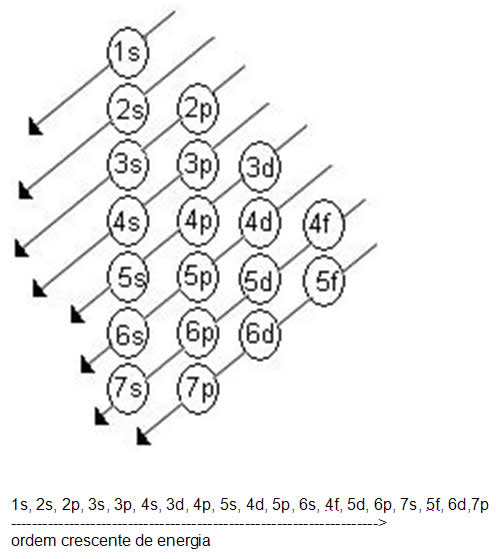
Você sabia que :
Até 1887, acreditava-se ser a menor partícula de matéria que se pudesse obter.
Naquele ano, o cientista inglês Joseph John Thomson anunciou a existência do elétron, mil vezes menor que o menor átomo conhecido, o do hidrogênio.
Curiosidade
Hoje, sabemos que o tamanho do átomo é de 10.000 a 100.000 vezes maior que o seu núcleo. Para efeito de comparação, podemos imaginar o núcleo atómico como uma formiga no centro de um estádio como o Maracanã (dos maiores estádios do mundo, situado no Brasil)
Até 1887, acreditava-se ser a menor partícula de matéria que se pudesse obter.
Naquele ano, o cientista inglês Joseph John Thomson anunciou a existência do elétron, mil vezes menor que o menor átomo conhecido, o do hidrogênio.
Curiosidade
Hoje, sabemos que o tamanho do átomo é de 10.000 a 100.000 vezes maior que o seu núcleo. Para efeito de comparação, podemos imaginar o núcleo atómico como uma formiga no centro de um estádio como o Maracanã (dos maiores estádios do mundo, situado no Brasil)
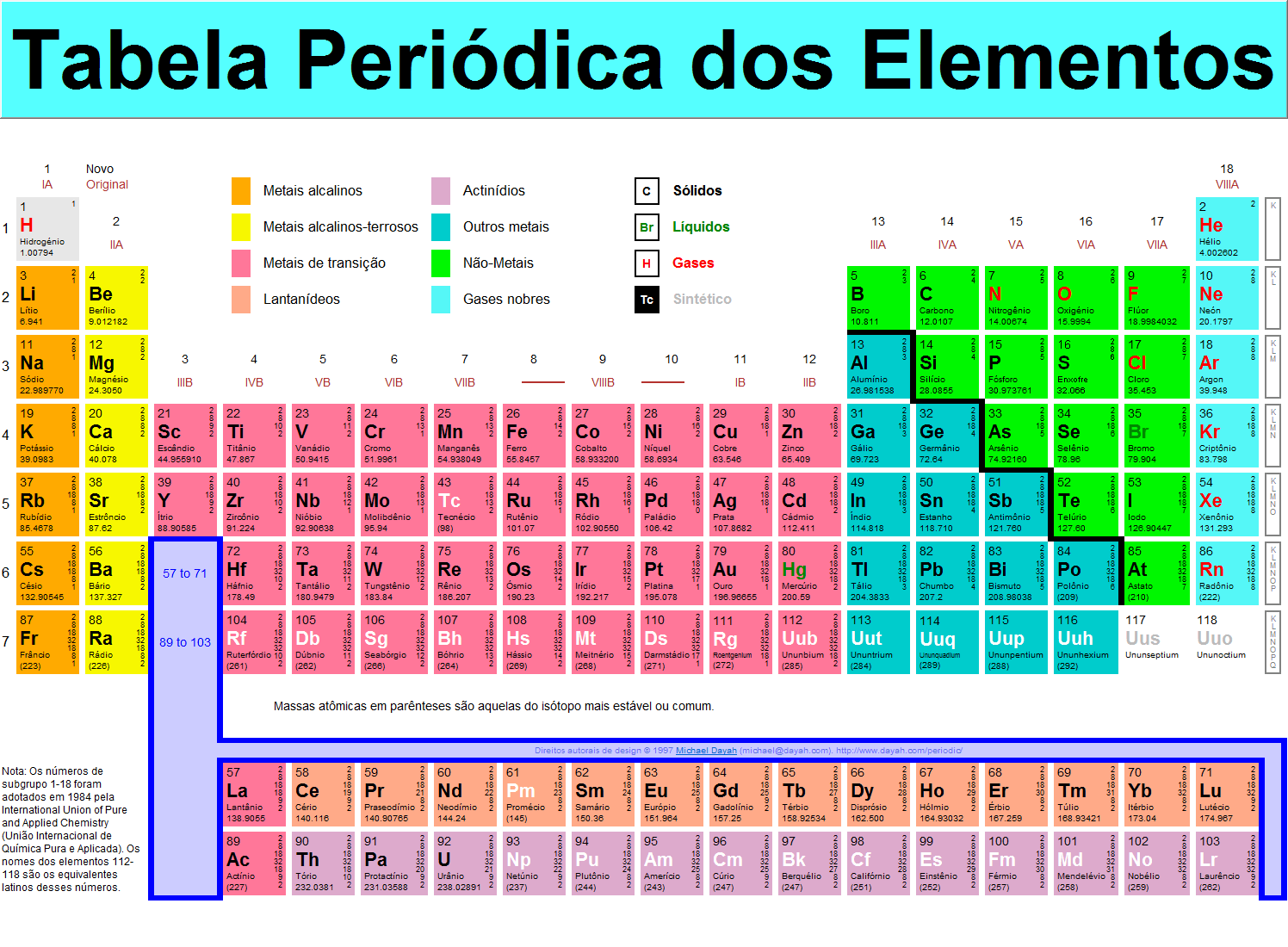
Elementos não citados:
85 astatine (1940)
93 neptunium (1940)
94 plutonium (1940)
95 americium (1944)
96 curium (1944)
97 berkelium (1949)
98 californium (1950)
99 einsteinium (1952)
100 fermium (1952)
101 mendelevium (1955)
102 nobelium (1958)
103 lawrencium (1961)
104 ruterfordium (1969)
105 hahnium (1970)
106 seaborgium (1974)
116 sem nome (1999)
118 sem nome (1999).
TAMBÉM
· Os elementos da família do carbono (grupo 14 da Tabela Periódica) constituem 27,7% da crosta do nosso planeta.
· O hidrogénio é o elemento mais abundante no universo e que foi a partir dele que os outros elementos químicos se formaram através de processos de fusão nuclear ocorridos em estrelas das dimensões do Sol e de dimensões maiores.
· Os nomes dos elementos químicos têm diversas origens. Dez deles são muito antigos, 8 têm o nome de corpos celestes, 10 referem-se a seres mitológicos, 13 têm nomes de minerais, 9 têm a ver com a cor, 10 mencionam o lugar geográfico onde foram encontrados, 14 referem-se ao País em que as descobertas foram feitas, 16 têm nomes de acordo com algumas características do elemento e 14 têm o nomes de cientistas e os mais recentes, 6, têm a numeração em latim.
· A vitamina D é fixada no organismo através de reacções fotoquímicas e que para isso é necessário apanhar sol.
· O que resulta da emulsão do azeite no vinagre por acção da gema de ovo é a maionese.
· Por que é que o milho das pipocas rebenta?
O milho é muito duro e contém pequenas bolhas de ar no interior. Quando o milho aquece, o ar retido no interior dilata e ao expandir-se, aumenta mais de 20 vezes o seu volume. As moléculas do ar movimentam-se com rapidez e pressionam cada vez mais fortemente as paredes resistentes das pequenas bolhas, até que elas se rompem e os grãos de milho explodem em pipocas leves e macias.
O milho é muito duro e contém pequenas bolhas de ar no interior. Quando o milho aquece, o ar retido no interior dilata e ao expandir-se, aumenta mais de 20 vezes o seu volume. As moléculas do ar movimentam-se com rapidez e pressionam cada vez mais fortemente as paredes resistentes das pequenas bolhas, até que elas se rompem e os grãos de milho explodem em pipocas leves e macias.